干電池,也稱為一次性電池,是一種常見的電源裝置,具有簡單且有效的工作原理。其內(nèi)部結(jié)構(gòu)由正極、負極和電解液組成。正極為二氧化鋅(ZnO2),負極為鋅(Zn),電解液則是一種稀酸溶液。當干電池連接到一個電路中,并產(chǎn)生負載時,電解液中的離子開始移動。這種移動使得負極的鋅離子轉(zhuǎn)化為鋅離子和電子的結(jié)合物。離子的移動還會引起電解液中氧化鋅顆粒的溶解,從而釋放電子。這些電子隨即通過電路流動,以滿足負載的需求。同時,在電化學反應中,鋅離子會與電解液中的酸反應生成氫氣和水。這樣,電化學反應的進行繼續(xù)維持著干電池的工作。
干電池的工作原理實際上是基于氧化還原反應的原理,即正極上的二氧化鋅被還原成鋅,而鋅則氧化為鋅離子。這個過程是通過電解液中的氫離子在電極之間的移動來實現(xiàn)的。這個移動過程會導致電解液中的氧化鋅溶解和負極上的鋅溶解。而當干電池連接到一個電路上時,這個氧化還原反應就會開始進行,產(chǎn)生所需的電流。
然而,干電池最終會因為正極和負極材料的耗盡而失效。在反應過程中,鋅負極不斷溶解,正極的二氧化鋅也在消耗,從而降低了電池的電勢差。當材料耗盡到一定程度時,電池的輸出電壓會急劇下降,無法繼續(xù)供應足夠的電流,電池就無法正常工作了。
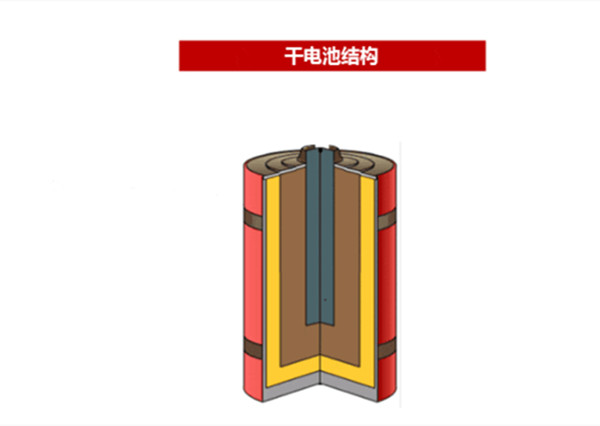
干電池結(jié)構(gòu):這是最早被使用的電池,普通干電池大都是錳鋅電池,中間是正極碳棒,外包石墨和二氧化錳的混合物,再外是一層纖維網(wǎng),網(wǎng)上涂有很厚的電解質(zhì)糊,其構(gòu)成是氯化氨溶液和淀粉,另有少量防腐劑,結(jié)構(gòu)如圖1。
干電池工作原理: 干電池的主要工作原理就是氧化還原反應在閉合回路中實現(xiàn),化學方程式為:Zn+2MnO2+2NH4Cl=ZnCl2++Mn2O3+2NH3+H2O,金屬鋅皮做的筒,也就是負極,電池放電就是氯化氨與鋅的電解反應,釋放出的電荷由石墨傳導給正極碳棒,鋅的電解反應會釋放氫氣的,這氣體是會增加電池內(nèi)阻的,和石墨相混的二氧化錳就是用來吸收氫氣。
總之,干電池的工作原理可以簡單概括為氧化還原反應的進行。電解液中的氧化鋅溶解和鋅負極的溶解產(chǎn)生所需的電子流動,從而滿足電路的需求。然而,由于正負極材料的消耗,干電池最終會失效。因此,干電池通常被視為一次性電源,一旦耗盡就需要更換。
